Nombre sistemático: pruebas genéticas para el tratamiento dirigido del cáncer
Aspectos generales
¿En qué consisten las pruebas genéticas para el tratamiento dirigido del cáncer?
Las pruebas genéticas para el tratamiento dirigido del cáncer detectan mutaciones en el ADN de las células cancerosas. El hecho de conocer si el cáncer tiene alguna mutación en particular es de ayuda para seleccionar el tratamiento más efectivo. La presencia o ausencia de ciertas mutaciones permite predecir qué individuos pueden beneficiarse de un determinado tratamiento y quiénes no.
Se conoce como cáncer al crecimiento descontrolado de células anómalas. Son varios los factores que contribuyen a este crecimiento sin control. Uno de ellos es la disfunción de las proteínas implicadas en el desarrollo y maduración celular. Las proteínas pueden ser disfuncionales a consecuencia de mutaciones en el ADN del gen que codifica esas proteínas en concreto. Algunas mutaciones pueden dar lugar a la síntesis de proteínas incapaces de detener el crecimiento celular, mientras que otras mutaciones pueden conducir a la síntesis de proteínas que estimulan el crecimiento celular. El resultado de ambos tipos de mutaciones es la multiplicación incontrolada de células anómalas (cáncer).
La ciencia lleva tiempo estudiando estas alteraciones genéticas para intentar conocer mejor los mecanismos del cáncer y desarrollar fármacos que puedan combatirlo. Los objetivos de las investigaciones se focalizan en desarrollar fármacos que interrumpan el crecimiento del cáncer sin perjudicar a las células sanas. Estos fármacos reciben el nombre de fármacos dirigidos contra dianas específicas o fármacos para el tratamiento dirigido del cáncer. Se ha observado que determinados tipos de cáncer se asocian frecuentemente a determinados tipos de mutaciones. Aunque todos los cánceres no las presentan, en un porcentaje significativo de ellos sí se hallan dichas mutaciones asociadas. Los cánceres con las mutaciones suelen tener una respuesta más fácilmente predecible a determinados fármacos en comparación con los cánceres que no las tienen.
Estos hallazgos han conducido a dos desarrollos relevantes:
- Fármacos dirigidos contra proteínas altamente específicas asociadas a determinados tipos de cáncer: por ejemplo, los inhibidores de tirosina quinasa y los anticuerpos contra el receptor del factor de crecimiento epidérmico (EGFR).
- Pruebas genéticas que detectan la presencia de mutaciones en tejido canceroso: permite saber si la persona se beneficiará de un tratamiento concreto.
Se sigue investigando para conocer al máximo la genética del cáncer y para desarrollar nuevos tratamientos. Algunos tipos de cáncer dejan de responder a ciertos tratamientos que inicialmente habían resultado efectivos, lo que se denomina resistencia al tratamiento. Algunas de estas investigaciones es posible que permitan conocer los mecanismos por los que se desarrolla esta resistencia.
Preguntas comunes
¿Por qué son importantes estas pruebas?
El tratamiento estándar del cáncer suele consistir en cirugía, quimioterapia, radioterapia o una combinación de ellas. El tratamiento con fármacos quimioterápicos y con radioterapia pretende ralentizar el crecimiento del cáncer, impedir que se disemine a otras zonas (metástasis) o, en el caso de que se haya diseminado, destruir las células cancerosas metastásicas.
La quimioterapia actúa destruyendo las células que se están dividiendo y desarrollando de forma rápida. La radioterapia elimina las células en división al actuar sobre sus genes, lesionándolos e impidiendo que se sigan multiplicando
La quimioterapia actúa destruyendo las células que se están dividiendo y desarrollando de forma rápida. La radioterapia elimina las células en división al actuar sobre sus genes, lesionándolos e impidiendo que se sigan multiplicando. Ambos tipos de terapias afectan, tanto a células cancerosas como a células sanas, que se encuentren en división y desarrollo. Este fenómeno es el responsable de los importantes efectos adversos observados con estos tratamientos. Es crucial ajustar al máximo las dosis de tal manera que el tratamiento consiga destruir las células cancerosas a la vez que se minimiza el daño al tejido sano del organismo.
El tratamiento dirigido del cáncer constituye una modalidad de tratamiento del cáncer relativamente nueva. Este tratamiento permite emplear un fármaco que surte mayor efecto sobre el tejido canceroso que sobre el tejido sano, produciendo menos efectos secundarios que la terapia estándar. La terapia dirigida se basa en el hecho de que las células cancerosas son genéticamente distintas de las células sanas que las rodean. La terapia dirigida pretende distorsionar algunos procesos específicos que parecen ser esenciales para el crecimiento incontrolado de las células cancerosas. Actualmente se encuentran en auge los estudios que permiten analizar la respuesta al tratamiento de las células cancerosas obtenidas por biopsia antes de iniciar la terapia, para determinar la probabilidad de que el tumor responda al tratamiento.
Los fármacos empleados en la terapia dirigida son caros y solo suelen funcionar en las personas cuyo cáncer presenta exactamente la misma conformación genética frente a la cual se han desarrollado. Se deben realizar las pruebas genéticas antes del inicio del tratamiento, para poder seleccionar el tratamiento que tenga más probabilidades de funcionar en cada paciente.
Algunos fármacos empleados en el tratamiento dirigido del cáncer para los que se dispone de pruebas incluyen:
- Fármacos que se unen a receptores de la superficie celular impidiendo la transmisión de las señales de crecimiento.
- Fármacos constituidos por pequeñas moléculas con capacidad para atravesar la membrana celular para bloquear la transmisión de la señal de crecimiento al unirse a la parte activa del receptor.
¿Cómo se utilizan las pruebas genéticas para el tratamiento dirigido del cáncer?
Estas pruebas se usan con el objetivo de seleccionar el tratamiento más efectivo para ciertos tipos de cáncer. El médico podrá saber si las terapias dirigidas disponibles funcionarán o no en el paciente.
Los genes son las unidades básicas del material genético, los segmentos de ADN que suelen codificar la producción de proteínas específicas. Las alteraciones de ADN reciben el nombre de variantes (también polimorfismos o mutaciones) y es relativamente frecuente que tengan lugar en la población general. La mayoría de variantes se heredan y afectan a todas las células, aunque en ciertos casos aparecen en algunas zonas del cuerpo al envejecer, debido a la exposición a lo largo de la vida de radiación o tóxicos, o incluso sin una causa aparente. Estas mutaciones pueden dar lugar a un cáncer.
Estas mutaciones que conducen a un aumento de un tipo particular de proteína o la alteración de su función dentro del tejido tumoral. Los tumores con estas mutaciones tienden a progresar de manera más agresiva, es más probable que se diseminen a otras zonas del organismo (metástasis) o sean más resistentes a la quimioterapia estándar. Sin embargo, a veces es posible tratar el cáncer con fármacos que se dirigen específicamente contra las proteínas alteradas (dianas específicas). Las pruebas genéticas para el tratamiento dirigido del cáncer detectan mutaciones que codifican esas proteínas y permiten identificar tumores susceptibles de responder a este tipo de fármacos.
Asimismo, estas pruebas genéticas permiten identificar los tumores que no van a responder a este tipo de tratamiento. Existen mutaciones que hacen que el tumor no responda al tratamiento (resistencia). En estos casos, no se considera esta opción terapéutica.
¿Cuándo se solicitan estas pruebas?
En algunos tipos de cáncer, las pruebas se realizan en el momento del diagnóstico, en otros casos se realizan cuando se observa que el cáncer no responde a la quimioterapia. Se debe obtener una muestra de tejido tumoral, en ocasiones se puede utilizar la muestra obtenida mediante biopsia en el momento del diagnóstico.
Las pruebas se suelen realizar una única vez, ya que la combinación de genes (genotipo) del tumor no suele variar.
¿Cuáles pueden ser algunos ejemplos de estas pruebas?
Cada una de las pruebas genéticas empleadas para el tratamiento dirigido del cáncer identifica mutaciones en un único gen y el resultado es aplicable solamente para ese gen y tratamiento concreto.
En la tabla siguiente se describen algunos tipos de cáncer en los que pueden emplearse pruebas genéticas con la finalidad de tomar decisiones acerca del tratamiento frente a dianas específicas.
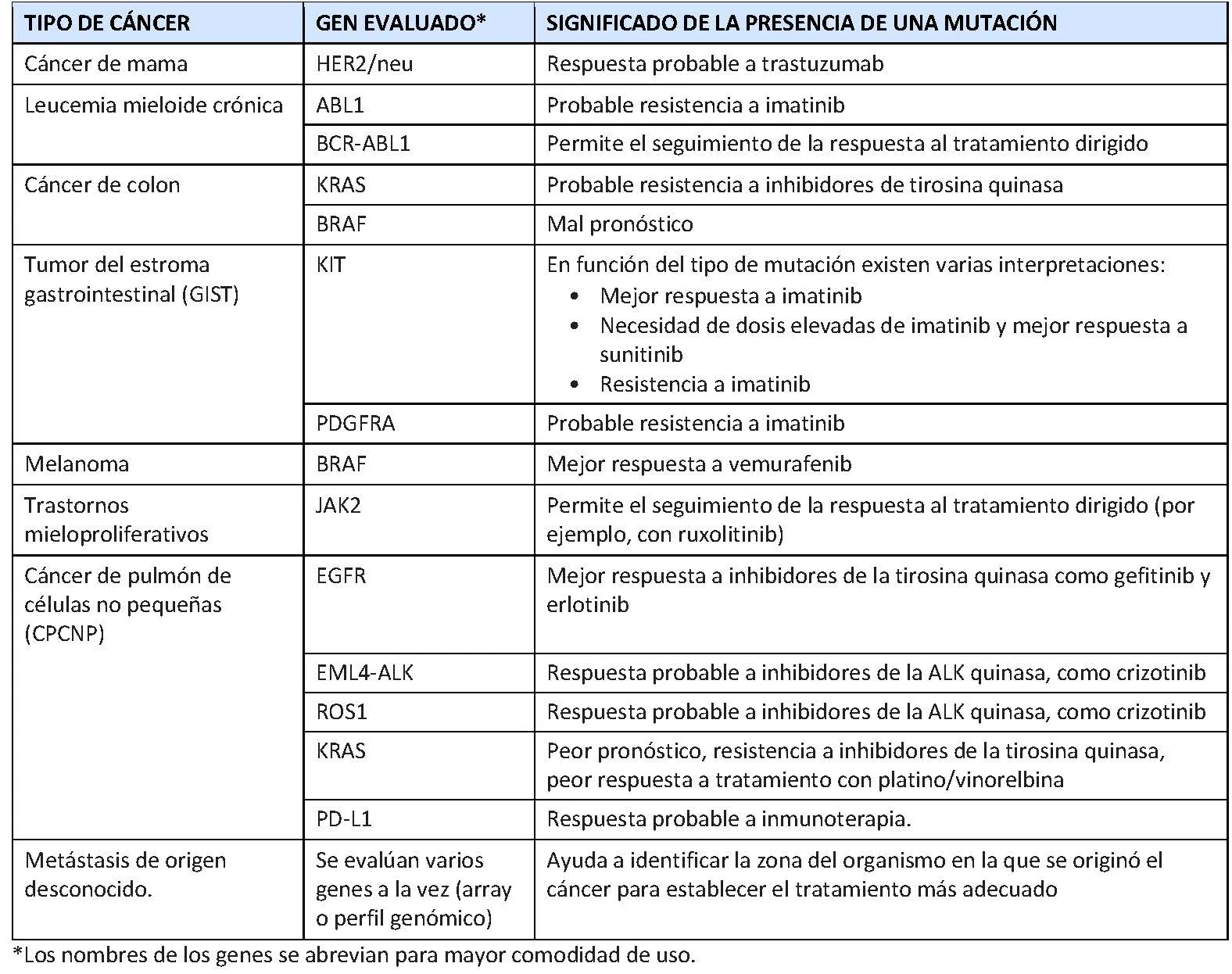
Generalmente, cada terapia dirigida se ha desarrollado al mismo tiempo que la prueba genética que permite evaluar su posible eficacia, de forma que es necesario realizar la prueba genética antes de administrar el tratamiento dirigido.
Los casos de cáncer asociados a una fuerte historia familiar y los que aparecen en personas jóvenes pueden tener características distintas a los que se desarrollan de modo esporádico en adultos. Por ejemplo, los casos pediátricos de GIST son muy diferentes de los casos en adultos y no suelen presentar las mutaciones KIT o PDGFRA.
Solamente se analizan las mutaciones más comunes. Un resultado negativo no descarta totalmente la posibilidad de que exista alguna mutación menos común. Es posible que para descartar la posibilidad de que exista alguna otra mutación se tenga que obtener una nueva muestra.
Las pruebas genéticas que son muy específicas no se usan rutinariamente con finalidades médicas. Sin embargo, esas pruebas genéticas pueden ser de gran utilidad con fines de investigación. Algunos ejemplos son:
- Cáncer de colon: PIK3CA y NRAS.
- Melanoma: KIT y NRAS.
- Trastornos mieloproliferativos: PDGFRA.
¿Se deberían realizar estas pruebas genéticas a todas las personas con cáncer?
Este tipo de pruebas solo están indicadas cuando una persona tiene un tipo determinado de cáncer para el cual está demostrado que un tratamiento dirigido puede ser eficaz, y en el caso de que el médico haya considerado empezar el tratamiento con el fármaco en cuestión.
¿Es posible que a pesar de recibir uno de estos tipos de tratamientos dirigidos no se obtenga beneficio alguno?
Sí. La mayoría de las personas con una prueba genética que indica que deberían beneficiarse del tratamiento responden al fármaco, pero cierto porcentaje no lo hará. Cada persona y cada cáncer es diferente.
¿Se pueden tomar estos fármacos dirigidos sin haber realizado las pruebas genéticas?
La mayoría de las veces no se recomienda. Los fármacos se han desarrollado para ejercer su acción en un contexto determinado. Si no se cumplen los criterios para los cuales se validó el fármaco, es posible que el cáncer no responda al tratamiento.
¿Se pueden realizar los estudios genéticos en la misma consulta médica o en un laboratorio cualquiera?
No. Para estas pruebas es indispensable una instrumentación especial y no todos los laboratorios disponen de ella. Normalmente la muestra se envía a un laboratorio de referencia.
Enlaces
Pruebas relacionadas:
Pruebas de expresión génica para el cáncer de mama
Receptor del factor de crecimiento epidérmico (EGFR)
Receptores de estrógenos y progesterona
Ligando 1 de muerte programada (PD-L1)
Estados fisiológicos y enfermedades:
Trastornos mieloproliferativos
Artículos:
En otras webs:
Sociedad Española de Medicina de Laboratorio (SEQCML): Guías de práctica clínica
American Cancer Society (ACS): Terapia dirigida
Instituto Nacional del Cáncer (NIH): Terapia dirigida para tratar el cáncer
American Cancer Society (ACS): Cáncer de pulmón
Instituto Nacional del Cáncer (NIH): Tratamiento del cáncer de pulmón de células no pequeñas (PDQ®)–Versión para pacientes
Sociedad Española de Oncología Médica (SEOM): Tumores del estroma gastrointestinal
Instituto Nacional del Cáncer (NIH): Cáncer colorrectal—Versión para pacientes
American Cancer Society (ACS): Detección temprana, diagnóstico y clasificación de la etapa del cáncer colorrectal
También conocido como: HSV-1, HSV-2, HHV1, HHV2, VHS, herpes oral, herpes labial, herpes genital
Nombre sistemático: virus del herpes simple tipo 1 y tipo 2
Aspectos generales
¿Por qué hacer el análisis?
Para hacer un cribado o un diagnóstico de la infección por el virus del herpes simple (VHS).
Pregúntenos














