Este artículo está dedicado a los estudios genéticos, es decir los que examinan la composición genética de un individuo con diversas finalidades. Como resultado de los continuos avances en la investigación biomédica, actualmente están disponibles un mayor número de pruebas genéticas que han revolucionado la forma de afrontar el diagnóstico de distintas enfermedades. La finalidad de los estudios genéticos es muy diversa, incluyendo entre otras:
- Estudios genéticos clínicos: nos permiten realizar un diagnóstico de una enfermedad que puede estar sufriendo el paciente o que aparezca de forma tardía, pero que influirá en su planteamiento de vida, por ejemplo, la enfermedad de Huntington.
- Estudios de farmacogenética: nos permiten no solamente evaluar la efectividad de un tratamiento farmacológico, sino también realizar la búsqueda del tratamiento más adecuado para un paciente.
- Estudios de pruebas de identidad: para investigaciones criminales o estudios forenses, son las denominadas "pruebas de ADN".
- Estudios de pruebas de paternidad: permiten esclarecer las relaciones de parentesco.
- Estudios de tipado de tejidos: buscar el órgano más compatible para el trasplante.
- Estudios citogenéticos: nos permiten encontrar la causa de pérdidas fetales o problemas reproductivos de las parejas, como en las portadoras de translocaciones equilibradas, que tienen un riesgo muy elevado de tener dichas pérdidas fetales o que sus hijos nazcan con graves patologías.
- Estudios de enfermedades infecciosas: permite la identificación del microorganismo causal, para indicar el tratamiento de una forma más eficiente.
- Estudios de genética molecular: es el análisis de enfermedades causadas por una mutación o variantes en un determinado gen, por ejemplo, el estudio de la fibrosis quística con variantes en el gen CFTR.
- Estudios de quimerismo: en aquellos pacientes con un trasplante de médula ósea para prevenir el rechazo.
Este artículo se centrará en los aspectos médicos de los estudios genéticos, aunque también se comentarán brevemente cada una de las finalidades citadas.
Acerca de las pruebas genéticas
Aspectos básicos de la genética
Se denomina genoma a toda la información genética de un individuo. El genoma es el conjunto completo de ADN que se encuentra localizado en una célula y está organizado en cromosomas. Cada célula humana tiene 23 pares de cromosomas, la mitad de cada par se hereda de la madre y la otra mitad del padre.
De los 23 pares de cromosomas, 22 se llaman autosomas; el otro par denominado gonosomas está formado por los cromosomas sexuales X e Y, que determinan el sexo del individuo. Los hombres tienen un cromosoma X y un cromosoma Y, mientras que las mujeres tienen dos cromosomas X.
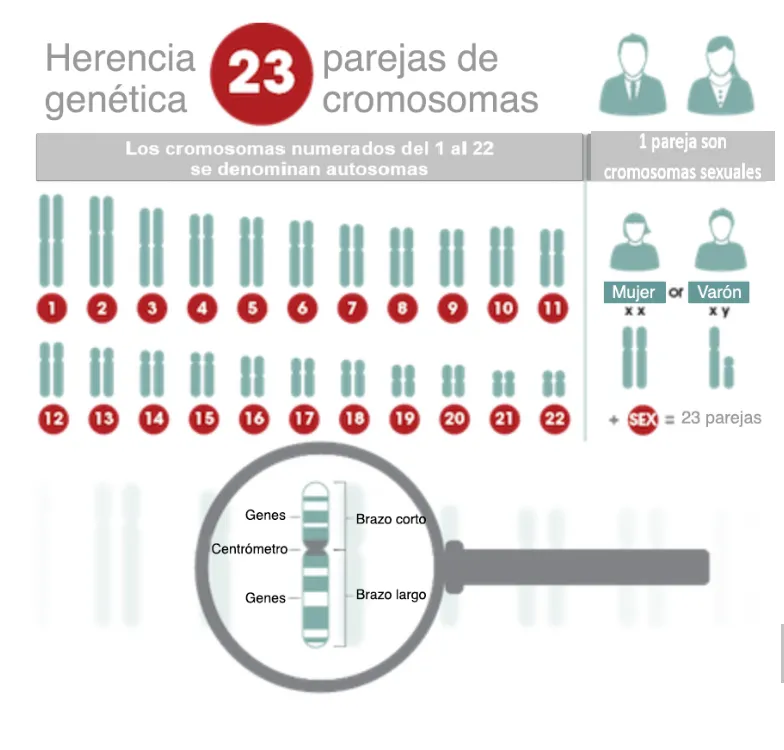
El ADN de doble cadena (ADN nuclear) se encuentra en el núcleo de las células contenida en cada cromosoma y está organizada en muchas subunidades de información genética, cada subunidad se denomina gen. Los genes están formados por nucleótidos, que a su vez están compuestos de un grupo fosfato, un azúcar y una base nitrogenada.
Existen cuatro bases distintas en el ADN: adenina (A), guanina (G), citosina (C), y timina (T). La diferente disposición de estas bases en cada cadena de ADN es lo que conduce a la singularidad de la composición genética de cada persona, y se usan en la síntesis del ácido ribonucleico (ARN), que a su vez dará lugar a una proteína. Se estima que el genoma humano consta de cerca de 20.000 genes que codifican las proteínas que componen nuestro organismo.
Una pequeña cantidad de ADN no se encuentra en el núcleo de la célula, sino en las mitocondrias, que son estructuras celulares que se encuentran en el citoplasma de la célula y que tienen su propio material genético, es el ADN circular, que se denomina "ADN extranuclear" o "ADN mitocondrial", que difiere del material genético del núcleo. Las mitocondrias producen la mayor parte de energía de la célula y parte de las proteínas necesarias para el correcto funcionamiento de la mitocondria.
El genotipo de una persona es su identidad genética. Es la combinación específica de los genes que tiene en sus células. El genotipo no se muestra en términos de apariencia externa. Los rasgos o características externas, como el color del cabello o de los ojos, la estatura etc, constituyen el fenotipo de una persona. El fenotipo es la expresión física del genotipo. Los fenotipos de las personas son diferentes, no solamente porque el genotipo es diferente en cada individuo, sino también por el ambiente, estos dos factores genéticos y ambientales nos convierten en seres únicos.
Las variantes de una secuencia especifica de ADN se denominan polimorfismos, en algunos casos pueden predecir una respuesta a un fármaco, aumentar el riesgo de padecer una enfermedad o ser una alteración de la normalidad.
Existen polimorfismos de secuencias de cambio de una base, denominados polimorfismos de un solo nucleótido (SNP), o de repeticiones de una región, polimorfismos de repetición (STRP).
Los polimorfismos genéticos, tanto en el ADN nuclear como en el ADN mitocondrial, ayudan a identificarnos como individuos. Este tipo de polimorfismos se denominan variaciones genéticas o mutaciones, y pueden ser heredados o formarse de novo. Algunos de estos polimorfismos han tenido lugar a lo largo del tiempo en un intento de nuestros organismos de protegernos de las enfermedades. Sin embargo, en ocasiones estos polimorfismos están relacionados con una enfermedad, o con la incapacidad de metabolizar normalmente los medicamentos. Estos polimorfismos se explican en el apartado relativo a las enfermedades que tienen un componente genético (enfermedades genéticas), tales como la fibrosis quística. En ocasiones difieren en un solo nucleótido y esto se conoce como SNP. Esto se explicará con mayor detalle en la sección sobre estudios genéticos clínicos. Es importante recordar que no todas las variaciones genéticas o mutaciones son dañinas o conducen a una enfermedad.
Patrones hereditarios
Las distintas formas en que se pueden transmitir los polimorfismos de un individuo por vía hereditaria se denominan "patrones hereditarios" y conducen a la transmisión de un polimorfismo o una variante de una generación a otra.
- El patrón autosómico dominante es aquel en que la transmisión de una única variante en un gen es suficiente para causar la aparición de un determinado rasgo (como puede ser el color de los ojos o una determinada enfermedad). El gen puede ser heredado de la madre o del padre. Las personas con un rasgo o enfermedad autosómica dominante tienen una probabilidad del 50% de transmitir el gen polimórfico a sus hijos. La hipercolesterolemia familiar, la acondroplasia y la enfermedad de Huntington son ejemplos de enfermedades autosómicas dominantes.
En ocasiones se manifiestan en un mismo individuo dos genes dominantes, presentes uno en cada miembro de la misma pareja de cromosomas. Por ejemplo, el tipo de sangre AB, en el cual el antígeno A y el antígeno B se localizan los dos en los glóbulos rojos de un individuo. Esto se conoce como codominancia.
- Un segundo patrón hereditario es el denominado autosómico recesivo en el que, para que se exprese el rasgo o la enfermedad, se requiere la herencia de la variante en ambos genes heredados en de cada uno de los progenitores, es decir, en el gen heredado de la madre y del padre.
Si el individuo hereda solamente una de las variantes de un gen, no desarrollará la enfermedad, sino que será un portador de la misma, al igual que su padre o su madre; a su vez puede transmitir la variante a sus hijos. Ejemplos de enfermedades autosómicas recesivas son la fibrosis quística, la anemia falciforme y la hemocromatosis.
- Los patrones hereditarios ligados al sexo son aquellos en los que la variante del gen se encuentra en el cromosoma sexual X o Y. En las enfermedades recesivas ligadas al cromosoma X, una mujer es portadora del gen alterado en uno de sus dos cromosomas X, pero debido a que posee una copia normal del gen, no se ve afectada. Sin embargo, como los hombres tienen un único cromosoma X, una única copia alterada del gen en su cromosoma X (heredado de su madre) es suficiente para dar lugar a la enfermedad. Es el caso de la distrofia muscular de Duchenne y la hemofilia.
Si una enfermedad es dominante y ligada al cromosoma X, una única variante en un gen en el cromosoma X puede hacer que se desarrolle la enfermedad. Suele ser un patrón de herencia muy raro, y suele ser letal en los varones. Por ejemplo, la enfermedad de Charcot-Marie-Tooth tipo 1
- El cromosoma Y es muy pequeño y contiene pocos genes, por lo que hay pocos trastornos genéticos relacionadas con los genes que contiene. Estas enfermedades afectan solamente a los hombres, ya que las mujeres no tienen cromosoma Y, asociándose la mayoría de ellas a infertilidad y defectos en el desarrollo de los órganos reproductores masculinos. Un ejemplo seria la hipertricosis.
- El tipo de herencia “modo materno” ocurre con el ADN mitocondrial (o "ADN extranuclear") que se hereda solamente de las madres. Ejemplo, la neuropatía óptica hereditaria de Leber.
Hay muchos factores que pueden enmascarar o complicar los patrones de herencia, y que a su vez afectan a la forma en que un gen es heredado o expresado.
Estudios genéticos clínicos
En los estudios genéticos clínicos se investiga el ADN o ARN con finalidades diagnósticas. Estos estudios pueden estar dirigidos a diferentes situaciones:
- Establecer un diagnóstico definitivo.
- Ayudar a predecir la probabilidad de desarrollar una determinada enfermedad, antes de que presente sintomatología.
- Proporcionar información acerca de si una persona es portadora de una variante o mutación en un gen específico que podría transmitirse a sus hijos.
- Proporcionar información sobre si determinado tratamiento tendrá éxito, antes de que el paciente comience la terapia.
En algunos casos, las ventajas de las pruebas genéticas respecto de otro tipo de pruebas de laboratorio son claras, ya que permiten llegar a resultados definitivos. Sin embargo, en algunos casos debe meditarse y pedir consejo genético, para comprender si es oportuno realizar el estudio.
Siempre para realizarse un estudio genético se debe de firmar un consentimiento informado, y recibir una consulta pre-test y después del estudio.
Estos aspectos se revisan en la sección titulada pros y contras de pruebas genéticas.
En una era de responsabilidad del paciente sobre su propia salud, es importante explicar al paciente este tipo de análisis, para que pueda valorar con conocimiento las ventajas y los inconvenientes de los estudios genéticos.
Muestras para estudios genéticos
Los estudios genéticos se pueden realizar en una gran variedad de muestras, tales como sangre, orina, saliva, heces, tejidos corporales, huesos o cabello.
Se aíslan las células de estas muestras y se extraen los ácidos nucleicos (ADN o ARN) que se estudian en busca de posibles variantes o alteraciones.
Estudiar pequeñas porciones de ADN de un gen requiere métodos de laboratorio específicos y muy especializados dirigidos a identificar la ubicación exacta de los errores genéticos. Esta sección se centrará en el análisis de los genes de un individuo, para detectar uno o más genes responsables de una determinada enfermedad.
Existen cuatro motivos distintos por los que se estudia el material genético con finalidades clínicas:
1. Estudios genéticos presintomáticos: para identificar la presencia de alteraciones genéticas que pueden producir una enfermedad, antes del que el individuo presente síntomas asociados a dicha enfermedad, por ejemplo, las enfermedades de aparición tardía.
2. Estudios genéticos diagnósticos: se realizan en pacientes con síntomas suficientemente sugestivos de un trastorno genético y son útiles para establecer un diagnóstico definitivo.
3. Estudios genéticos de portadores: se realizan para evaluar si los futuros padres tienen una alteración en algún gen que pueda causar patología a sus futuros hijos, será importante no solamente conocer el gen donde se encuentra la variante patogénica, sino también el tipo de herencia, para conocer el riesgo de transmitir la enfermedad.
4. Estudios genéticos prenatales: se realiza el estudio sobre material genético del feto. Se llevan a cabo por alteraciones ecográficas del feto o porque alguno de los progenitores o ambos son portadores de variantes que pueden causar enfermedad.
5. Estudio genético preimplantacional: se realizará el estudio de las variantes de interés, sobre embriones previamente a su trasferencia.
Para estudiar el ADN con fines clínicos se requiere algún tipo de material celular. Este material puede provenir de sangre, orina, saliva, tejidos corporales, médula ósea, cabello, etc. El material puede enviarse al laboratorio en un tubo, en un hisopo, en un recipiente o congelado. Si el estudio requiere ARN, se pueden usar los mismos materiales. Una vez en el laboratorio, se aíslan las células, se rompen y se extrae el ADN del núcleo.
Los profesionales de laboratorio que realizan e interpretan estos estudios son médicos, farmacéuticos, biólogos o químicos, especialmente formados. El ADN extraído se trata de diferentes maneras, para que el profesional y el técnico puedan estudiar las alteraciones que causan una determinada enfermedad. Un primer tratamiento consiste en dividir el ADN en pequeños fragmentos utilizando enzimas especiales. Estos pequeños fragmentos son mucho más fáciles de estudiar que las largas cadenas de ADN y contienen los genes que interesa estudiar. Una forma de estudiar los fragmentos de ADN consiste en una electroforesis sobre gel de agarosa; para ello se colocan los fragmentos de ADN en un gel de agarosa y se aplica un campo eléctrico al gel, para observar finalmente el desplazamiento del ADN sobre el gel. De este modo se ponen de manifiesto las posibles diferencias en el tamaño de los fragmentos de ADN que puede ser debido a mutaciones o variantes específicas.
Existen otros métodos de estudio de ADN tales como la amplificación, la hibridación y la secuenciación.
La secuenciación del ADN consiste en determinar el orden de las bases A, C, G y T en un fragmento de ADN. Las primeras secuenciaciones se realizaron mediante electroforesis en geles de poliacrilamida, posteriormente se desarrolló la técnica de secuenciación de Sanger que permitió automatizar el proceso y actualmente se utiliza la secuenciación masiva que permite realizar múltiples secuencias cortas de forma paralela. De este modo, se pueden analizar numerosos genes a la vez.
Al comparar los resultados de estos estudios con los resultados obtenidos en personas normales es posible detectar las diferencias en los genes que pueden ocasionar una determinada enfermedad.
Enfermedades genéticas
Existen muchas enfermedades que actualmente se cree que son causadas por alteraciones en el ADN. Estas alteraciones pueden ser heredadas o pueden ocurrir espontáneamente.
Ejemplos de enfermedades con un componente genético son:
- Alteraciones de la médula ósea.
- Anemia falciforme.
- Cáncer de colon.
- Cáncer de mama.
- Cáncer de ovario.
- Enfermedad de Alzheimer.
- Fibrosis quística.
- Hemocromatosis.
- Hipercolesterolemia familiar congénita.
- Leucemia.
- Lupus.
- Linfoma.
- Osteoartritis.
- Síndrome de Down.
- Talasemia
Las distintas alteraciones del ADN pueden dar lugar a estas y otras enfermedades. En la siguiente sección se exponen los cambios que pueden ocurrir en el ADN y específicamente en los genes, para que puedan ocasionar una enfermedad.
Variación genética y mutación
Todas las variaciones genéticas o polimorfismos se originan por un proceso de mutación. Las variaciones genéticas, a veces se producen durante el proceso de división de las células somáticas (mitosis), aunque también pueden darse variaciones genéticas durante la meiosis, ciclo de división de un espermatozoide o de un óvulo. Algunas variaciones se transmiten a lo largo de las generaciones, agregando más y más cambios a lo largo de los años. Algunas veces estas mutaciones dan lugar a una enfermedad, pero otras veces no existe un efecto nocivo.
Las variaciones genéticas se pueden clasificar en diferentes categorías: variaciones genéticas estables, variaciones genéticas inestables, variaciones genéticas silenciosas y otras.
1. Las variaciones genéticas estables: son causadas por cambios específicos en un único nucleótido. Estos cambios se llaman polimorfismos de un solo nucleótido (SNP) y pueden ser:
- Sustituciones: en las que un nucleótido es reemplazado por otro.
- Deleciones: en las que se pierden uno o varios sólo nucleótidos.
- Inserciones: en las que uno o más nucleótidos se insertan en un gen.
Si el SNP da lugar a una proteína truncada, no funcional, se denomina "mutación sin sentido". Un ejemplo es la anemia falciforme, en la que un nucleótido es sustituido por otro, y la variación genética en el gen hace que se agregue un aminoácido diferente a una proteína, lo que da como resultado una proteína que no realiza correctamente su función y da lugar a que los glóbulos rojos tengan forma falciforme y no transporten oxígeno.
2. Las variaciones genéticas inestables: tienen lugar cuando una secuencia de nucleótidos, generalmente 3 (tripletes) se repite continuamente. Esto se llama "repetición" y generalmente es normal; sin embargo, si el número de repeticiones es muy elevado, se denomina "repetición expandida" y es la causa de muchos trastornos genéticos. Un ejemplo de una enfermedad causada por una repetición expandida es la enfermedad de Huntington, trastorno grave que afecta al cerebro y que origina demencia, hidrocefalia y movimientos inusuales.
3. Las variaciones genéticas silenciosas (mutaciones sin sentido): son aquellas mutaciones o cambios en un gen que no alteran la proteína resultante. Estas mutaciones rara vez dan lugar a enfermedades.
Otros tipos de variaciones tienen lugar cuando un gen entero se duplica en algún lugar del genoma de una persona. Cuando esto ocurre hay copias adicionales del gen y se produce un exceso de proteína. Esto tiene lugar en la enfermedad de Charcot-Marie-Tooth tipo 1, que afecta a los nervios periféricos.
Algunas variaciones tienen lugar en la zona del gen que controla la copia del ADN al ARN y cuando se pierde el ritmo de producción de la proteína, se traduce en una reducción de la síntesis de esta proteína.
Otras variaciones incluyen un defecto en un gen que produce una proteína que sirve para reparar el ADN roto de nuestras células. Esta variación puede dar lugar a muchos tipos de enfermedades, tales como el cáncer colorrectal y una enfermedad de la piel llamada xeroderma pigmentaria.
Análisis de los productos de expresión genética
Muchos trastornos hereditarios se identifican indirectamente investigando las anormalidades en los productos finales de expresión de los genes (proteínas o metabolitos), ya sea porque se presenten en cantidades o en formas anormales. Hay que recordar que los genes codifican la producción de miles de proteínas y, si hay un error en el código, pueden ocurrir cambios en la producción de esas proteínas. En estas pruebas, en lugar de detectar el problema en el gen, se buscan las alteraciones relacionadas con las proteínas que produce, o la ausencia de estas proteínas.
Un ejemplo de análisis de productos de expresión genética son los utilizados para investigar una serie de trastornos en los recién nacidos, permitiendo un cribado neonatal a través de la prueba del talón.
Por ejemplo, a los recién nacidos se estudian enfermedades metabólicas, como por ejemplo la fenilcetonuria (PKU), un trastorno metabólico autosómico recesivo heredado, causado por una mutación en un gen que produce un enzima especial que descompone el aminoácido fenilalanina. Cuando este enzima no se produce en la cantidad necesaria se produce una acumulación de fenilalanina en sangre, que puede conducir a un retraso mental si no se inicia tempranamente una dieta especial. El análisis se realiza en una muestra de sangre de talón del bebé, para buscar el exceso de fenilalanina.
Otros ejemplos de este tipo de análisis son los que se llevan a cabo para la detección del hipotiroidismo congénito, diagnosticado por el hallazgo de valores bajos o ausencia de hormona tiroidea en sangre; también aquellos para la detección de la hiperplasia suprarrenal congénita, una enfermedad genética que causa un déficit de cortisol en sangre.
Una vez que se ha detectado la enfermedad se complementan con el estudio genético para buscar la variante que la causa, ampliando el estudio a los progenitores para conocer el tipo de herencia de la variante, si es heredada o de novo, para poder dar un adecuado asesoramiento genético a la pareja para futuras gestaciones.
Estudios de farmacogenética
En algunas ocasiones se observa que un individuo responde exageradamente a un tratamiento, mientras que en otros casos el medicamento no hace ningún efecto. Estos comportamientos frente al medicamento son debidos a la genética del individuo, y el estudio de estos aspectos se denomina farmacogenética.
Por ejemplo, una paciente a la que se le extirpó un tumor por cirugía, con un buen postoperatorio, se le administró codeína como analgésico. Inmediatamente desarrolló una erupción cutánea en todo el cuerpo, con dificultad para respirar y con latidos cardíacos irregulares. Se le interrumpió la codeína y desaparecieron todos estos síntomas. Posteriormente se sometió a un estudio y se observó que carecía del enzima que metaboliza la codeína en morfina y otros metabolitos, por lo que la concentración de codeína en sangre era excesiva, tenía una sobredosis de codeína. La falta de este enzima está directamente relacionada con una mutación en el gen que codifica para la producción de este enzima.
Esta variación genética es un polimorfismo entre los individuos normales y aquellos que lo portan. A veces, estos polimorfismos pueden causar una reacción muy grave en un individuo que puede conducir a la muerte.
En otros casos, los individuos presentan un exceso de enzima y metabolizan muy rápidamente el fármaco, lo que provoca una falta de respuesta al medicamento. Esto puede suceder cuando existen demasiadas copias del gen y se produce un exceso de enzima.
En otros casos, falta el receptor especial al que se une el fármaco en las células o los tejidos, debido a una mutación en el gen que produce la proteína receptora. Cuando no hay un receptor que se una al medicamento, este no tiene ningún efecto sobre las células o tejidos sobre los que debería actuar.
Los estudios genéticos para determinar los polimorfismos que desempeñan un papel en la respuesta frente a un fármaco forman parte de los análisis genéticos básicos. El ADN se extrae de las células, se aísla un área específica de un cromosoma específico y se compara con el ADN normal. De esta forma, se pueden observar variaciones genéticas que pueden desempeñar un papel en la respuesta excesiva o insuficiente a un fármaco terapéutico. Esta prueba también puede determinar la resistencia o sensibilidad de un individuo a la efectividad de ciertos medicamentos utilizados en la terapia viral (por ejemplo: medicamentos para el VIH o la hepatitis C).
En nuestro organismo hay gran cantidad de enzimas, cuya misión es fragmentar o metabolizar diferentes medicamentos para posibilitar su excreción por la orina. Actualmente se realizan evaluaciones integrales que nos permiten darnos una visión general de nuestras variaciones genéticas específicas, que pueden ocasionar que no respondamos o respondamos en exceso a un medicamento.
Estudios de pruebas de identidad
Las pruebas de identidad se denominan comúnmente "pruebas de ADN", término que se usa frecuentemente en las investigaciones penales, aunque es un término inapropiado, ya que todos los tipos de estudios genéticos, cualquiera que sea el objetivo final, implican la evaluación de ADN o ARN.
Las pruebas de identidad tienen como objetivo la identificación de un individuo a través del análisis de ADN nuclear o mitocondrial extraído de algún material: sangre, tejido, pelo, hueso, etc. Cualquier material que contenga células nucleadas puede usarse para extraer ADN nuclear para la realización de las eventuales pruebas. El ADN mitocondrial, extranuclear, solamente se usa cuando la muestra está muy degradada, o bien si se dispone únicamente de cabello sin células adheridas.
Las pruebas de identidad cada vez son más usadas para identificar a un sospechoso en una investigación criminal, comprobando si el ADN encontrado en la escena del crimen coincide con el del sospechoso. Cuando se condena a un individuo, su identidad genética se incorpora a un banco de datos al que pueden acceder los agentes del orden público. Este sistema se conoce como CODIS o "Sistema Combinado de Índice de ADN". Este sistema ha ayudado a resolver muchos crímenes y también a exonerar a acusados injustamente de un crimen.
Otra utilidad de las pruebas de identidad es la de identificar a las personas cuya identidad no puede establecerse por otros medios, como sucede cuando el cuerpo está descompuesto. En este tipo de pruebas genéticas, se examinan las partes específicas del ADN en busca de polimorfismos (diferencias) exclusivos del individuo. Estas partes de la cadena de ADN se denominan microsatélites o minisatélites y se componen de subunidades repetidas de la cadena de ADN. Estas subunidades repetidas se llaman repeticiones cortas en tándem (STR), o bien número variable de repeticiones en tándem (VNTR). En la medicina forense, estas secuencias únicas reciben el nombre de "huella digital de ADN".
Algunos tipos de pruebas de identidad van dirigidas a establecer la paternidad de una persona, por ello se denominan comúnmente "pruebas de paternidad"; técnicas similares se usan también para el “tipado de tejidos”, identificar los donantes y receptores idóneos, para la realización de un trasplante de órganos.
Estudios de pruebas de paternidad
El objetivo principal de las pruebas de paternidad es identificar al padre biológico de un niño. Se hace para determinar el padre o padres de un individuo, por ejemplo, en los casos de adopción o en casos de supuesta paternidad. Esta prueba debe realizarse con mucho cuidado y debe identificar al supuesto padre con un 99% de certeza.
Se pueden realizar diferentes tipos de pruebas de laboratorio para evaluar el parentesco, incluido el examen de antígenos de glóbulos rojos (tipaje sanguíneo), el examen de genes de proteínas séricas polimórficas y la evaluación de repeticiones cortas en tándem. Las técnicas de pruebas de ADN utilizadas son similares a las utilizadas en las pruebas de identidad para una investigación criminal, es decir, extraer ADN de las células y manipularlo de tal forma que se pueda examinar la singularidad individual de las mismas.
Si después de probar varios sistemas, el padre en disputa no se excluye como posible padre, se debe realizar una estimación matemática de la posibilidad de que la persona evaluada sea el padre biológico. Esta estimación matemática combina los resultados de las pruebas genéticas con otros "eventos no genéticos" (ubicación del supuesto padre en el momento de la concepción, fenotipo del padre e hijo, etc.) y da como resultado un "índice de parentesco". Este índice refleja la probabilidad de paternidad expresada como porcentaje. Los resultados de estas pruebas son admisibles como evidencia en el tribunal.
Estudios de tipado de tejidos
Al inicio de las técnicas de trasplante de órganos (riñón, pulmón, médula ósea etc..) era muy difícil conocer por adelantado el grado de compatibilidad entre donante y receptor. Al no conocerse la posible incompatibilidad, se podía producir un rechazo grave entre el paciente receptor y el órgano trasplantado.
Antes de un trasplante de tejido, las pruebas de laboratorio son básicas para establecer la compatibilidad entre donante y receptor. Inicialmente se realizaban pruebas que implicaban mezclar los leucocitos del donante (o del tejido del donante) y los del receptor, y observar si se producía una respuesta inmune, manifestada por la proliferación de una población específica de leucocitos, que sugería la posibilidad de rechazo del tejido por parte del receptor. Aunque esta técnica todavía está en uso, actualmente se emplea el análisis de ADN del donante y del receptor que conocemos como “tipado de tejidos”, lo que permite seleccionar al receptor más adecuado para aquel órgano, y así disminuir la probabilidad de rechazo del tejido trasplantado.
En los trasplantes de médula ósea, el rechazo puede ser inverso, es decir, la médula trasplantada puede rechazar al receptor; esto se conoce como enfermedad del injerto contra el huésped. Para evitarlo, se realizan pruebas de ADN, para determinar si los leucocitos del donante pueden rechazar al receptor.
Cuando las pruebas de ADN se emplean para el tipado de tejidos se examina un conjunto muy específico de genes que reside en el cromosoma 6 denominado "complejo mayor de histocompatibilidad" o CMH. Estos genes son muy polimórficos (diferentes) entre individuos, y codifican para la producción de antígenos glicoproteicos específicos ubicados en la superficie de muchas células. Estos antígenos son los que "reconocen" nuestros propios órganos y tejidos de los órganos y tejidos de otro individuo, y tienen la capacidad de iniciar la respuesta del sistema inmune, que es la responsable del rechazo del órgano o tejido trasplantado.
Para el análisis de ADN del tejido que podría trasplantarse se usa una región del CMH, denominada región del antígeno leucocitario humano o región HLA-D. Los conjuntos de genes localizados allí se subdividen en HLA-DR, HLA-DQ y HLA-DP, dependiendo del tipo de antígeno glicoproteico para el que codifican. Para establecer la idoneidad del trasplante se comparan los polimorfismos de estos genes entre el donante y el receptor.
Las técnicas empleadas en el análisis de ADN para el tipado de tejidos son similares a las mencionadas en las secciones anteriores. El ADN se extrae de las células del donante y del receptor y se fragmentan de tal manera que se aísla una región específica de un cromosoma con un gen. Los fragmentos se someten a un análisis adicional que permite la comparación de los polimorfismos en el HLA-DP entre el tejido del donante y la sangre del receptor. Mediante este escrupuloso análisis del material genético se producen menos reacciones de rechazo haciendo posible un trasplante exitoso.
Estudios citogenéticos
Todo el mundo tiene 23 pares de cromosomas, 22 pares de autosomas y un par de cromosomas sexuales. La ciencia que estudia los cromosomas se conoce como "citogenética". Las personas que examinan las preparaciones cromosómicas son tecnólogos citogenéticos o citogenetistas. Un citogenetista experimentado examina el número, la forma y el patrón de tinción de estas estructuras usando técnicas especiales, de esta forma puede detectar cromosomas adicionales, falta de cromosomas o cromosomas reorganizados.
El estudio de los cromosomas se inicia con la extracción de cromosomas completos del núcleo de las células. Estos cromosomas se colocan luego en un portaobjetos de cristal, se realizan tinciones especiales y se examinan al microscopio. Algunas veces se fotografían los cromosomas, y se recortan para identificar los pares de cromosomas. En base a su patrón de tinción y a su forma y tamaño se asigna a cada par de cromosomas un número (del 1 al 22, y también el X e Y).
Muchas alteraciones pueden diagnosticarse mediante el examen de los cromosomas completos de una persona. En el síndrome de Down el individuo tiene un cromosoma 21 adicional, que puede establecerse mediante estudios citogenéticos. Cuando en vez de un par de cromosomas hay tres se denomina "trisomía". También puede detectarse la ausencia de un cromosoma, como en el caso del síndrome de Turner, consiste en que una mujer tiene un solo cromosoma X. Cuando solamente hay un cromosoma en lugar de un par se denomina "monosomía".
También existen enfermedades por expansión como el síndrome X frágil, que se debe al aumento del número de tripletes CGG en el gen FMR1 que se encuentra en la parte distal del brazo largo del cromosoma X. El síndrome X frágil es la causa hereditaria más común de retraso mental y se produce cuando el numero de expansiones (aumentos) está por encima de 200 repeticiones CGG, haciendo que el gen pierda actividad y no se produzca la proteína FMRP (proteína del retraso mental del cromosoma X frágil, por sus siglas en inglés).
En ocasiones se desprenden fragmentos de un cromosoma y se unen a otro cromosoma en algún lugar del genoma de una persona, se conoce como "translocación". Un ejemplo de una enfermedad causada por una translocación es la leucemia mieloide crónica (LMC), en la cual una parte del cromosoma 9 se desprende y se une al cromosoma 22. Otro ejemplo es el linfoma de Burkitt, en el que una parte del cromosoma 8 se une al cromosoma 14. Estas translocaciones cromosómicas causan enfermedades, porque la parte rota de un cromosoma generalmente se une al otro cromosoma, cerca de un gen especial que se activa y da lugar a la producción de células tumorales. En algunas ocasiones se pueden observar translocaciones mediante el análisis citogenético con tinciones especiales.
Se puede usar una técnica especial llamada hibridación fluorescente in situ (FISH) para ver los cambios en los cromosomas causados por las variaciones genéticas. Un segmento génico aberrante en un cromosoma puede producir fluorescencia cuando se une a una sonda especial. Mediante este método pueden detectarse los cambios genéticos en algunos tipos de cáncer. Por ejemplo, el FISH es uno de los métodos utilizados para determinar el aumento del número de copias (amplificación) del gen ERBB2 (también conocido como HER2/neu) en el cáncer de mama. Hay también otras aplicaciones de la tecnología FISH, como las microdeleciones cromosómicas, en las que una parte específica de un cromosoma falta por completo. En este caso, el segmento cromosómico no emitirá fluorescencia, a diferencia de la fluorescencia producida por un conjunto normal de cromosomas.
Estudios de enfermedades infecciosas
Al hablar de "enfermedad infecciosa", generalmente se piensa en “algo” que puede infectarnos y provocarnos una enfermedad. Ese "algo" puede ser una bacteria, un virus, un parásito, un hongo procedente de gran variedad de orígenes distintos (otras personas infectadas, falta de higiene, transfusión con sangre infectada, agujas compartidas entre usuarios de drogas, etc.). Las bacterias y los virus que causan enfermedades se conocen como agentes infecciosos, y algunos de ellos se pueden identificar rápidamente mediante el uso de técnicas genéticas. Sin embargo, la identificación de los agentes infecciosos más comunes, como ciertas bacterias y virus, es mucho más económica si se realiza mediante métodos clásicos de laboratorio, en vez de usar los estudios genéticos.
- Las bacterias son organismos unicelulares que contienen su propio ADN y que en algunos casos pueden causar una enfermedad grave, incluso las bacterias que habitan en nuestros organismos y que están involucradas en procesos químicos beneficiosos pueden mutar y ocasionar una enfermedad. Las bacterias se pueden identificar con rapidez aislando su ADN, fragmentándolo y amplificándolo. Así se puede identificar la Chlamydia trachomatis, que causa la clamidiasis, enfermedad de transmisión sexual (ETS); la Neisseria gonorrhea, que causa la gonorrea, la Borrelia burgdorferi que causa la enfermedad de Lyme; la Legionella pneumophilia que causa la enfermedad del legionario; el Mycoplasma pneumoniae que causa la "neumonía del paseante"; el Mycobacterium tuberculosis que puede causar tuberculosis y la Bordetella pertussis que causa tosferina. Estas bacterias se pueden estudiar en muestras de orina, sangre, esputo, líquido cefalorraquídeo y otros líquidos biológicos.
- Los virus son organismos que a veces insertan su ADN en el genoma del huésped. El ARN o ADN viral utiliza las células del huésped para producir proteínas y producir más virus. Unos virus insertan ARN, como el virus de la hepatitis C (VHC) y el virus de la inmunodeficiencia humana (VIH). Otros virus insertan ADN, como los virus del herpes simple, citomegalovirus, virus de Epstein-Barr, parvovirus y varicela zoster. Todos estos virus se pueden identificar extrayendo primero el ADN o ARN viral de una muestra del paciente. Las muestras estudiadas son sangre, líquido cefalorraquídeo, esputo, otros líquidos corporales, líquido amniótico, tejido o médula ósea. En los análisis de sangre de donantes se usan estudios genéticos en busca de una posible contaminación vírica. Otra aplicación de los estudios genéticos de enfermedades infecciosas es establecer el número de copias de ARN vírico existentes en la sangre de un individuo infectado. La cantidad de copias presentes se denomina "carga viral" o "carga vírica". Este estudio se suele realizar después de iniciar una terapia farmacológica para evaluar si hay disminución o eliminación de la carga viral. Las pruebas de carga viral más comunes son las realizadas para el virus de la hepatitis C y el virus del VIH. El estudio se lleva a cabo en muestras de sangre.
- Un parásito es un organismo multicelular complejo. Los parásitos generalmente infectan a un individuo a través de la saliva de un insecto, como un mosquito, o a través de material infectado. Un ejemplo de parásito que puede identificarse mediante estudios genéticos es el Toxoplasma gondii, que puede dar lugar a encefalitis o a infecciones congénitas que provocan graves daños al feto (toxoplasmosis fetal).
Estudios de genética molecular
Consiste en el análisis de enfermedades causadas por una mutación o variantes en un determinado gen, por ejemplo, el estudio de la fibrosis quística con variantes en el gen CFTR.
El gen CFTR codifica para un canal de cloro; variantes o mutaciones en este gen causan la enfermedad de fibrosis quística al tener un patrón de herencia recesiva necesita tener dos mutaciones patogénicas, y ser heredadas cada una de ellas de un progenitor.
La fibrosis quística afecta principalmente a los pulmones, al crear un moco espeso, y presenta signos y síntomas variables.
Estudios de quimerismo
Se realizan en aquellos pacientes con un trasplante de médula ósea para prevenir el rechazo.
Los estudios de quimerismo permiten detectar el rechazo de la médula ósea en un paciente trasplantado; esto implicaría una revisión de las dosis o el tratamiento inmunosupresor del paciente. Para realizarlo se utilizada un estudio de microsatélites, mientras no se produce rechazo solamente se observaría el perfil del donante, y si existe se verían dos perfiles mezclados, es decir, los marcadores de microsatélites correspondiente al donante y al huésped.
Pros y contras de los estudios genéticos
Los estudios genéticos tienen un gran potencial para la atención médica del futuro, presentan grandes ventajas, aportando importante información para la toma de decisiones, para formar una familia o para cuidar la propia salud. Sin embargo, también tienen limitaciones, por ello es importante comprender la naturaleza de los estudios genéticos y la información que pueden o no pueden proporcionar.
- Los estudios genéticos clínicos no son solamente resultados descriptivos, como muchas pruebas de laboratorio (como el valor de glucosa en la sangre), sino que también son predictivos. Las pruebas predictivas no dan una respuesta de sí o no, sino que indican la probabilidad de desarrollar una determinada enfermedad genética. No obstante, estos resultados no son definitivos y pueden dejar a una persona con la duda sobre qué hacer con esos resultados, particularmente si hay posibles tratamientos o terapias disponibles.
- Un determinado estudio genético solamente informará de la existencia o no de una variación genética específica o mutación, no puede garantizar si se desarrollará la enfermedad en cuestión, ni proporciona información sobre otras enfermedades genéticas que no se buscan específicamente en este estudio.
- Aunque la prueba puede detectar un determinado problema en un gen, no puede predecir con qué gravedad se verá afectada la persona portadora. Por ejemplo, en el caso de la fibrosis quística, los síntomas pueden ir desde anomalías bronquiales leves a graves problemas pulmonares, pancreáticos e intestinales, dependiendo de la mutación específica presente.
- Muchos estudios genéticos no pueden detectar todas las variaciones que pueden causar una determinada enfermedad. Por ejemplo, en los estudios genéticos para la fibrosis quística, la mayoría de los paneles de estudios genéticos solamente investigan las variantes más comunes, no todas las que están asociadas con esta enfermedad.
- Muchas enfermedades son el resultado de una interacción entre los genes y el entorno. No queda claro de qué forma estas interacciones causan la enfermedad. Algunos ejemplos de este tipo de enfermedades son la enfermedad coronaria, la diabetes tipo 2, la obesidad y la enfermedad de Alzheimer.
- Se deben considerar los aspectos legales, tales como la privacidad del paciente, el uso de estudios genéticos para determinar la cobertura del seguro y el uso de muestras de pacientes archivadas.
Debido a estas limitaciones, los resultados de las pruebas genéticas son un arma de doble filo. Es absolutamente imprescindible el consentimiento informado para realizar estudios genéticos y saber lo que desea hacer con los resultados del estudio, conocer sus derechos legales y asegurarse de respetar la privacidad. El paciente debe informarse sobre los estudios genéticos y consultar con su médico si cree que debe realizarse un estudio genético. Esto es especialmente importante, porque cada vez están disponibles más estudios genéticos.
También es importante recordar que los estudios genéticos son diferentes de otros tipos de pruebas de laboratorio. Los resultados de los estudios genéticos pueden tener implicaciones no solamente para el paciente, sino también para los familiares, que también pueden necesitar un estudio. Por ello se aconseja la educación genética y el consejo genético, para ayudar a comprender los resultados de los estudios genéticos. Los consejeros genéticos son profesionales capacitados para ayudar a las personas con familiares con una alteración genética a comprender mejor estas afecciones heredadas. También pueden identificar familias en riesgo de ciertos trastornos genéticos y ofrecer apoyo y asesoramiento, así como actuar como defensores de los pacientes.
El futuro: avances, potencial, conclusiones
Con la finalización del Proyecto del Genoma Humano, hemos aprendido que la palabra "normal" ya no tiene sentido cuando se trata de la composición genética de una persona. Las variaciones genéticas ocurren en grandes cantidades en nuestro genoma. Todos somos únicos, no solamente en nuestra personalidad y apariencia, sino también en nuestro genotipo.
Los científicos continúan trabajando para entender mejor la estructura de nuestra composición genética, lo que podría permitir avances importantes en la prevención y el tratamiento de muchas enfermedades.
La terapia génica es una opción para tratar enfermedades potencialmente letales o discapacitantes causadas por alteraciones de un único gen. Con técnicas especializadas se puede manipular la expresión génica para corregir el problema en el paciente en particular, aunque la corrección no se transmitirá a la descendencia. Es decir, las correcciones se realizan a nivel de la molécula del ADN, para compensar el gen anormal, de modo que los síntomas perjudiciales de la enfermedad no se expresen en el paciente. La terapia génica todavía está en fase experimental, se están llevando a cabo ensayos clínicos para ver si se puede utilizar para desarrollar tratamientos para enfermedades, como el cáncer, las enfermedades cardiacas y el SIDA.
Los nuevos avances en tecnología y técnicas de biología molecular han sido espectaculares en los últimos años. Uno de ellos, la secuenciación de nueva generación (NGS) ha permitido secuenciar múltiples genes a la vez de una manera rápida y económica acortando mucho los tiempos de diagnóstico de enfermedades de origen genético.
Actualmente se desarrollan estudios genéticos mediante NGS para predecir el pronóstico o los resultados adversos de respuesta, ayudando a tratar solamente a aquellos pacientes que responderán a la terapia. También se está avanzando en la comprensión de algunos cánceres complejos, como el mieloma múltiple y el linfoma. Sin duda, habrá más y más avances en la investigación genética que impactarán en los estudios de laboratorio disponibles para todos los pacientes con objeto de realizar la detección y el tratamiento de una gran variedad de enfermedades.
Enlaces
En otras webs:
Clínica Universidad de Navarra: Genes y Herencia Genética
Medline: Cómo entender la genética
National Library of Medicine: ¿Por qué es importante la genética para mí y mi familia?
Genotipia: 10 Conceptos básicos para introducirte en el mundo de la Genética











